Вирус оспы тип его генома
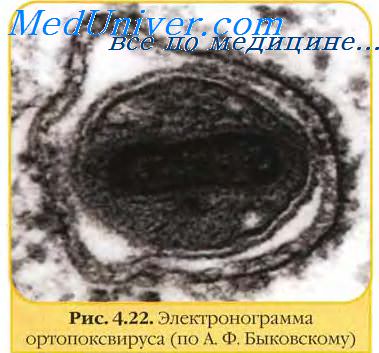
Геном вирусов оспы. Антигены вирусов оспы.Геном вирусов оспы представлен одной линейной молекулой двуцепочечной ДНК с ковалентно замкнутыми концами размером 130 тпн (парапоксвирусы) — 280 тпн (авипоксвирусы). На обоих концах генома имеются идентичные, но противоположно ориентированные тандемы повторяющихся нуклеотидных последовательностей. Геномы вирусов оспы способны кодировать около 200 белков, из которых не менее 100 входят в структуру вириона. Однако функциональные особенности определены лишь у небольшого количества вирусных белков. Наиболее важными из них являются ферменты, участвующие в синтезе вирусных нуклеиновых кислот и структурных компонентов вирионов. Например, синтез ДНК-полимеразы, ДНК-лигазы, РНК-полимеразы, энзимов, связанных с кэппированием и полиаденилированием мРНК и тимидинкиназы. Инфекционные вирусные частицы содержат системы транскрипции, которые могут выполнять in vitro синтез РНК, а также способны полиаденилировать, кэппировать и метилировать. В вирусных частицах содержится большое количество кодируемых вирусом энзимов и других биологически активных факторов. Некоторые гены вирусов оспы кодируют белки, которые секретируются инфицированными клетками и вызывают ответ организма на инфекцию, в том числе и формирование иммунитета. К таким вирокинам относятся гомологичный эпидермальный фактор роста, белок, снижающий активность комплемента, вирокины, обеспечивающие устойчивость к интерферону, и другие супрессоры иммунного ответа, подавляющие действие некоторых цитокинов организма хозяина. Вирусы оспы обычно характеризуются узким спектром хозяев. Они передаются чаще респираторным путем и реже через поврежденную кожу. Вирусы оспы овец, свиней, птиц и миксоматоза передаются также через укус членистоногими. Вирусы оспы устойчивы в окружающей среде и могут сохраняться годами в высохших струпьях кожи или других вируссодержащих материалах.
Большинство вирусов оспы хорошо размножаются в культуре клеток. Исключение составляют парапоксвирусы, вирус оспы свиней и вирус контагиозного моллюска. Однако они, так же как и ортопоксвирусы, легко образуют оспины на хориоал-лантоисной оболочке куриных эмбрионов. Вирусы оспы размножаются в цитоплазме, и, в отличие от других ДНК-вирусов, их размножение происходит независимо от ядра клетки, благодаря кодированию всех ферментов, необходимых для транскрипции и репликации вирусного генома. Некоторые из этих функций выполняются вирионами как таковыми. После слияния оболочки вириона с плазматической мембраной клетки или после эндоцитоза вирусная сердцевина освобождается в цитоплазму. Транскрипция вирусного генома характеризуется каскадностью, когда каждый временной класс генов («ранние», «промежуточные» и «поздние» гены) требует наличия специфических транскрипционных факторов, которые создаются предшествующим временным классом генов. Факторы, обеспечивающие транскрипцию промежуточных генов, кодируются ранними генами, тогда как факторы транскрипции поздних генов кодируются промежуточными генами. Транскрипция начинается вирионной транскриптазой и другими факторами, находящимися в сердцевине вириона, которые способны образовывать мРНК спустя минуты после инфицирования. Белки, образующиеся в результате трансляции этих мРНК, включая ДНК-полимеразу, тимидинкиназу и несколько других ферментов, необходимы для репликации вирусной ДНК. Репликация ДНК ВО связана с синтезом конкатемерных промежуточных структур, которые затем разрезаются с образованием единиц геномной длины. Детали этого процесса недостаточно изучены. С началом репликации ДНК происходит резкий сдвиг в генной экспрессии. Транскрипция «промежуточных» и «поздних» генов контролируется специфическими вирусными белками. Некоторые продукты транскрипции ранних генов образуются на поздней стадии инфекции, упаковываются в вири-оны и используются в следующем круге инфекции. Так как в состав вирусов оспы входит большое количество белков, не является неожиданным, что сборка вирионов есть комплексный процесс, который длится несколько часов и все еще целиком не выяснен. Образование вириона связано с вхождением ДНК внутрь незрелой сердцевинной структуры, которое затем завершается включением наружных покрывающих слоев. Репликация и сборка вирионов происходят в разных местах цитоплазмы в так называемых виропластах или вирусных фабриках. Вирионы выходят из клетки почкованием (оболочечные вирионы), или путем экзоцитоза, или при лизисе клеток (вирионы без оболочки). Большинство вирионов освобождаются при цитолизе и не имеют оболочки. Вирионы с оболочкой и без нее обладают инфекционностью, но первые, вероятно, играют более значительную роль в возникновении и распространении заболевания, а также в создании иммунитета. В очищенном вирусе осповакцины (ВОВ) выявлены белки с молекулярной массой 10-250 кД. Многие из них сосредоточены в сердцевине вириона. Два структурных гликопротеина располагаются между оболочкой и сердцевиной. В оболочке ВОВ содержится около 10 белков, из которых иммунологически наиболее активны крупномолекулярные белки с молекулярной массой 58—32 кД (VP4c, VP6a, VP6b и VP7a). Белок 32 кД определяет круг хозяев и важен для репликации вируса. В составе очищенного вируса оспы птиц обнаружено 29 полипептидов с молекулярной массой 14-138 кД. Наивысшей антигенной и иммуногенной активностью обладают полипептиды с молекулярной массой 35 и 37 кД. За индукцию вируснейтрализующих антител ВО ответственны антигены, расположенные на поверхности наружной оболочки вириона, и прежде всего белок 58 кД (VP4c), являющийся основным структурным компонентом трубочек (ворсинок). Антисыворотка к этому белку нейтрализовала инфекционность вируса и предотвращала образование синцития в культуре клеток. Этот белок ответственен за выработку иммунитета. Внеклеточные вирионы покрыты дополнительной наружной оболочкой, отсутствующей у внутриклеточных вирионов. Она играет важную роль в индукции синтеза ВН-антител. Инфекционность ВОВ и ВО крупного рогатого скота, имеющих наружную оболочку, нейтрализовалась антисывороткой к имеющему эту оболочку ВОВ, но не нейтрализовалась антисывороткой к ВОВ, лишенному наружной оболочки. За гемагглютинирующую активность ортопоксвирусов ответственны полипептид 85 кД и гликопротеид 41 кД. Во внеклеточном оболочечном ВОВ гемагглютинирующие свойства связаны с полипептидом 85 кД. Внутриклеточные вирионы (без дополнительной оболочки) практически не содержали этого полипептида. Неструктурный гемагглютинин формируется на цитоплазматических мембранах. С его образованием инфицированные клетки приобретают способность адсорбировать эритроциты. Вирусспецифические белки с молекулярной массой 32 и 37 кД, экспрессируемые на поверхности клеток, инфицированных ВОВ, делают их мишенями для специфических цитотоксических Т-лимфоцитов. МАТ-реактивные против каждого из пяти (54; 34; 32; 29 и 17—25 кД) белков наружного слоя поверхности вируса осповакцины нейтрализовали его инфекционность. В структуре полипептида 54 кД обнаружено два нейтрализующих эпитопа(Аи В). Анализ антигенных детерминант поверхностных полипептидов, проведенный с помощью МАТ, выявил в составе ортопоксвирусов, наряду с видоспецифическими, группоспецифические эпитопы. — Также рекомендуем «Оспа овец. Оспа птиц. Особенности оспы овец и птиц.» Оглавление темы «Частная вирусология.»: |
Источник
Поксви́русы[2] или вирусы оспы[3] (лат. Poxviridae, от англ. рох — оспа + вирусы) — семейство вирусов животных, объединяющее самые крупные ДНК-содержащие вирусы, вирионы которых имеют кирпичеобразную или овоидную форму; включает виды, патогенные для человека, например, возбудителей оспы, пустулезного дерматита.
Геном, представленный двунитчатой линейной гантелеобразной формы ДНК, покрыт двухслойным капсидом, между слоями которого находятся боковые тела. Поверх нуклеокапсида расположена двухслойная липопротеидная оболочка с воронкообразными фибрами.
Репродукция вируса[править | править код]
Поксвирусы обладают наиболее сложным репродуктивным циклом, при этом синтезируется более 100 различных белков, входящих в состав вирионов (большинство образует наружную оболочку). Репродукция поксвирусов характеризуется следующими особенностями.
- Транскрипция ДНК начинается до полной депротеинизации вируса, так как она полностью осуществляется белками, имеющимися в вирионе.
- Репликация происходит только в цитоплазме и полностью независима от клеточных полимераз, так как, в отличие от прочих вирусов, поксвирусы имеют собственную ДНК-зависимую РНК-полимеразу, которая обеспечивает транскрипцию генов репликации в течение ранней и средней стадий.
В репродуктивном цикле выделяют три стадии[4]:
- Ранняя стадия репродукции поксвирусов запускается сразу же после раздевания вируса и выхода вирусной ДНК в цитоплазму. На этой стадии за счёт РНК-полимеразы вириона транскрибируются гены, необходимые для репликации генома.
- На средней стадии транскрибируется примерно половина вирусной ДНК. Транслируются мРНК, синтезированные в раннюю стадию. Транскрибируются средние гены.
- Поздняя стадия репродукции поксвирусов совпадает с началом репликации ДНК. Регуляторные белки блокируют трансляцию ранней мРНК и запускают синтез поздних (структурных) белков. Сборка вирионов осуществляется только в цитоплазме посредством реакций мембранного синтеза. Упаковка генома в вирион идёт с затратой АТФ. Высвобождение зрелых популяций сопровождается лизисом клетки.
Классификация[править | править код]
По данным Международного комитета по таксономии вирусов (ICTV), на январь 2020 года в семейство включают 2 подсемейства с 11 и 3 родами соответственно[5]:
- Подсемейство Chordopoxvirinae — Вирусы оспы позвоночных[2]
- Род Avipoxvirus — Авипоксвирусы[3] (10 видов, вирусы оспы птиц)
- Род Capripoxvirus — Каприпоксвирусы[3] (3 вида)
- Goatpox virus — Вирус оспы коз[6]
- Lumpy skin disease virus — Вирус кожной бугорчатки[3]
- Sheeppox virus — Вирус оспы овец[3][6] — типовой вид рода
- Род Centapoxvirus (1 вид)
- Род Cervidpoxvirus (1 вид)
- Род Crocodylidpoxvirus (1 вид)
- Род Leporipoxvirus — Лепорипоксвирусы[3] (4 вида)
- Myxoma virus — Вирус миксомы кроликов[3] — типовой вид рода
- Род Molluscipoxvirus — Моллюсципоксвирусы[3]
- Molluscum contagiosum virus — Вирус контагиозного моллюска[2][3]
- Род Orthopoxvirus — Ортопоксвирусы[3] (10 видов)
- Cowpox virus — Вирус оспы крупного рогатого скота[3] или вирус коровьей оспы[7]
- Monkeypox virus — Вирус оспы обезьян[2][6][7]
- Vaccinia virus — Вирус осповакцины[7] — типовой вид рода
- Variola virus — Вирус натуральной оспы
- Род Parapoxvirus — Парапоксвирусы[3] (4 вида)
- Orf virus — Вирус Орф[2] — типовой вид рода
- Род Suipoxvirus — Суипоксвирусы[3]
- Swinepox virus — Вирус оспы свиней[3]
- Род Yatapoxvirus — Ятапоксвирусы[3] (2 вида)
- Tanapox virus — Танапоксвирус человека[2] или вирус оспы Тана[2][3]
- Yaba monkey tumor virus — Вирус опухолей обезьян Яба[3] — типовой вид рода
- Виды incertae sedis (2 вида)
- Подсемейство Entomopoxvirinae — Вирусы оспы насекомых[2]
- Род Alphaentomopoxvirus (7 видов)
- Род Betaentomopoxvirus (16 видов)
- Род Gammaentomopoxvirus (6 видов)
- Виды incertae sedis (2 вида)
Примечания[править | править код]
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 1 2 3 4 5 6 7 8 Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 107—108. — ISBN 5-89481-136-8.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Вирусы и вирусные вакцины. — М. : Библионика, 2007. — С. 283—284. — ISBN 5-98685-012-2.
- ↑ Bernard Moss. Poxvirus DNA Replication (англ.) // Cold Spring Harbor Perspectives in Biology. — 2013. — September (vol. 5, iss. 9). — P. a010199. — ISSN 1943-0264. — doi:10.1101/cshperspect.a010199.
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Проверено 14 февраля 2020).
- ↑ 1 2 3 Список микроорганизмов, токсинов, оборудования и технологий, подлежащих экспортному контролю : [утв. Указом Президента РФ от 20 августа 2007 г. № 1083] : офиц. текст : по состоянию на 1 июня 2016 г.
- ↑ 1 2 3 Пиневич А. В., Сироткин А. К., Гаврилова О. В., Потехин А. А. Вирусология : учебник. — СПб. : Издательство Санкт-Петербургского университета, 2012. — С. 330, 335. — ISBN 978-5-288-05328-3.
Источник
Инструкция для террориста
Дарья Спасская, N+1
В январе журнал PLOS One опубликовал статью канадских исследователей, посвященную воссозданию в лаборатории вируса оспы лошадей – того самого, на основе которого Эдвард Дженнер в XVIII веке сделал первую в мире вакцину (Noyce et al., Construction of an infectious horsepox virus vaccine from chemically synthesized DNA fragments). Несмотря на то, что эксперименты были проведены несколько лет назад, статью приняли к публикации только сейчас. Фактически, статья продемонстрировала, что с относительно доступными технологиями ныне не существующий в природе вирус можно запросто синтезировать и воссоздать в лаборатории.
В связи с этим научная общественность раскололась на два лагеря: критики вопрошают, зачем вообще нужно было это делать и зачем журнал опубликовал статью? Вдруг ею захотят воспользоваться террористы, чтобы воссоздать смертоносный вирус черной оспы? Сторонники авторов, напротив, говорят, что статью нужно было опубликовать обязательно и что она должна стать поводом для формирования новых этических и законодательных норм, касающихся синтетической биологии.
Эпидемии натуральной, или черной, оспы практически непрерывно свирепствовали в Азии в Средние века и регулярно вспыхивали в Европе в Новое время вплоть до изобретения в конце XVIII века английским врачом Дженнером вакцины против нее. По легенде, Дженнер заметил, что коровы и лошади болеют особой формой оспы, а люди, работающие с ними, почти никогда не заражаются черной оспой. Врач предположил, что если заразить человека коровьей оспой, это предохранит его от развития более тяжелой формы заболевания. Свое предположение Дженнер успешно проверил на мальчике по имени Джеймс Фиппс. После этого вакцинация безопасной формой оспы вошла в общую практику и эпидемии оспы в Европе прекратились, однако болезнь продолжала уносить жизни людей в Азии и Африке.

Коровья оспа (Wellcome Images)
В XX веке исследователи выяснили, что возбудителем черной оспы является ДНК-вирус из семейства Poxviridae. На базе безопасных для человека родственников черной оспы из того же семейства были разработаны вакцины, которые помогли окончательно победить оспу на планете. Последний случай заражения был зарегистрирован в 1977 году, а в 1980 на Ассамблее ВОЗ официально было объявлено об искоренении заболевания. В настоящее время образцы смертоносного вируса хранятся только в двух институтах в Атланте и в Новосибирске.
Несколько лет назад руководитель канадской фармацевтической компании Tonix Сет Ледерман (Seth Lederman) заинтересовался вирусом оспы, который Дженнер использовал для вакцинации. Как выяснил исследователь, вопреки распространенной легенде возбудитель, которого выделил Дженнер, скорее всего был вирусом лошадиной оспы, а не коровьей. По крайней мере, геном предков того самого вируса, при помощи которого искоренили оспу в Европе, оказался больше всего похож на вирус HPXV, циркулирующий среди лошадей и найденный 40 лет назад в Монголии.
С тех пор лошадиный вирус оспы тоже был забыт, и, вероятно, последний его образец хранился в США в Центре по контролю над инфекционными заболеваниями (CDC). Туда и обратился Ледерман, чтобы исследовать возможности вируса в качестве вакцины. По словам биотехнолога, вирусные вакцины, которые были распространены в XX веке (VACV), далеко ушли от своего предка и накопили нежелательные мутации, которые усилили их способность размножаться в клетках человека. В связи с этим вакцинация в редких случаях может вызвать серьезные побочные эффекты, такие как повреждение сердечной мышцы. Использование исходного вируса должно быть более безопасным.
Несмотря на благие цели, декларированные Ледерманом, вирус ему не дали. Тогда он обратился за помощью к вирусологу Дэвиду Эвансу (David H. Evans), и исследователи самостоятельно воссоздали вирус в лаборатории. Для того чтобы получить геном вируса, который состоит из 212 тысяч пар оснований, исследователи просто заказали синтез нескольких фрагментов ДНК в фирме, предоставляющей соответствующие услуги. Затем ученые собрали вирус из частей в клетках, зараженных родственным ему поксвирусом кроликов. Секвенирование генома подтвердило, что вирус HPXV успешно удалось воссоздать. Исследователи также заразили им мышей и показали, что по сравнению с VACV он легче переносится животными и действительно обеспечивает иммунитет против высокой дозы VACV.
Несмотря на некоторую практическую и академическую ценность статьи, ее отклонили в двух журналах. В середине 2017 года Ледерман послал пресс-релиз в журнал Science, благодаря чему эта история впервые получила огласку. Сама статья была опубликована в 2018 году в журнале PLOS One, и, хотя представители редакции заявили, что не увидели причин отклонять статью, публикация вызвала обеспокоенность научной общественности и специалистов по биобезопасности.

Частицы вируса оспы (CDC).
Дело в том, что черная оспа, в качестве прививки против которой и использовалась вакцина Дженнера, рассматривается как потенциальное биологическое оружие. Так как с начала 80-х годов XX века людей перестали прививать от оспы за ненадобностью, современная популяция не защищена от внезапной вспышки болезни. «Что если террористы захотят воссоздать в лаборатории вирус черной оспы? Теперь у них есть точная инструкция, как это сделать, в виде публикации Эванса и Ледермана», – обеспокоены критики статьи. Конечно, манипуляции с вирусом черной оспы запрещены Всемирной организацией здравоохранения, но вряд ли террористы будут оглядываться на запреты, если захотят это сделать.
Другим аргументом критиков является ненужность подобной вакцины на основе воссозданного вируса. Помимо VACV, были разработаны другие, более безопасные варианты, которые лишены побочных эффектов. К тому же специалистам вообще непонятно, зачем бизнесмену Ледерману нужна новая вакцина – очевидно, что сейчас для нее нет рынка.
В реальности, судя по некоторым фактам о Ледермане, им двигал не коммерческий интерес. Исследователь является большим поклонником Дженнера и пишет его биографию. Возможно, воссоздание исходной «вакцинии», при помощи которой знаменитый врач спас Европу, было подпитано горячим интересом Ледермана ко всему, что связано с его кумиром. Ради этого он даже не пожалел сто тысяч долларов, потраченных из бюджета компании Tonix на синтез генома вируса лошадиной оспы.
Надо сказать, что, несмотря на внимание, которое привлекла данная публикация, возможность воссоздания вируса оспы была продемонстрирована еще в 2002 году, когда исследователи клонировали геном VACV в бактериях. Инженерия патогенных вирусов в целом тоже не редкость в лабораториях – к примеру, совсем недавно мы рассказывали о модифицированном вирусе гриппа, который был собран также в целях создания вакцины. Более того, показательная история произошла в 2011 году, когда две статьи, посвященные вирусу птичьего гриппа H5N1, были запрещены к публикации в результате угрозы биотерроризма. В этих статьях были описаны модификации вируса, благодаря которым тот стал способен заражать не только птиц, но и млекопитающих. Появление подобных статей привело к мораторию на исследования вируса птичьего гриппа, который был отменен, лишь когда научной общественности удалось договориться о том, что польза от подобных исследований перевешивает вред.
Поэтому множество ученых поддерживает «реконструкторов» вируса лошадиной оспы. Подобные публикации демонстрируют возможности синтетической биологии и очерчивают новый круг проблем перед регуляторными организациями. Если даже исследования с довольно туманными негативными последствиями, типа экспериментов с эмбрионами человека, ограничены законодательно, синтез вирусов в лаборатории, способный причинить куда более ощутимый вред, должен быть поставлен под контроль. «Кто-то рано или поздно должен был это сделать», – говорят сторонники Эванса и Ледермана.
Портал «Вечная молодость» https://vechnayamolodost.ru
Источник


